Изотермический процесс – это термодинамический процесс, при котором температура системы не изменяется. Он является одним из основных процессов, которые изучаются в физике и термодинамике. При изотермическом процессе тепловая энергия системы не изменяется, а работа, совершаемая внешней силой над системой, преобразуется во внутреннюю энергию газа.
Закон изотермического процесса был сформулирован Шарлем в физике и термодинамике. Он гласит, что для идеального газа давление и объем обратно пропорциональны при постоянной температуре. Таким образом, можно записать уравнение состояния идеального газа для изотермического процесса:
P * V = const,
где P — давление газа, V — его объем. Закон изотермического процесса позволяет определить изменение давления и объема газа при тепловом воздействии на него с постоянной температурой.
Особенностью изотермического процесса является то, что он может происходить только при определенных условиях. Важным условием является наличие теплоизолированной системы, которая позволяет поддерживать постоянную температуру. В реальных системах часто наблюдаются отклонения от строго изотермического процесса из-за потери тепла в окружающую среду или нагрева извне.
Определение и принципы изотермического процесса
Основной принцип изотермического процесса заключается в том, что для поддержания постоянной температуры системы необходимо компенсировать изменение энергии системы. Если объем системы увеличивается, необходимо добавить тепло, чтобы сохранить постоянную температуру. Если же объем системы уменьшается, необходимо отвести избыточное тепло, чтобы предотвратить повышение температуры.
Изотермический процесс наиболее часто встречается в газовых системах, которые находятся в теплопроводности с окружающей средой, либо в системах, где газы совершают работу при неизменной температуре. В таких процессах изучаются изменения давления, объема и количества вещества при постоянной температуре.
| Изотермический процесс: | Формула: |
|---|---|
| Закон Бойля-Мариотта: | p1V1 = p2V2 |
| Закон Шарля: | V1/T1 = V2/T2 |
| Закон Гей-Люссака: | p1/T1 = p2/T2 |
Изотермический процесс имеет особенности, связанные с сохранением постоянной температуры системы и изменяемыми параметрами, такими как давление и объем. Законы Бойля-Мариотта, Шарля и Гей-Люссака позволяют описать зависимости между этими параметрами в изотермическом процессе. Изучение таких процессов является важной частью термодинамики и находит широкое применение в различных областях науки и техники.
Определение и понятие
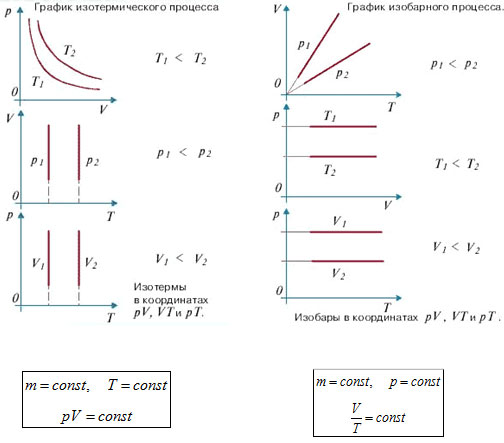
Изотермический процесс можно представить в виде горизонтальной прямой на графике давления в зависимости от объема. Также изотерма – линия, на которой отмечены состояния системы при постоянной температуре.
Важно отметить, что изотермический процесс протекает при постоянной температуре только при идеальных условиях. В реальных системах изменение температуры может быть незначительным, но все же происходит.
Изотермические процессы широко используются в различных областях, таких как химия, физика и машиностроение. Они играют важную роль в понимании законов термодинамики и характеризуют поведение веществ при постоянной температуре.
Закон сохранения энергии в изотермическом процессе
В изотермическом процессе, происходящем при постоянной температуре, закон сохранения энергии остается действительным. Это означает, что сумма кинетической и потенциальной энергии газа остается постоянной на протяжении всего процесса.
В изотермическом процессе газ совершает работу над окружающей средой или получает работу от окружающей среды. Эта работа связана с изменением внутренней энергии газа.
Сумма работы и изменения внутренней энергии равна нулю, так как энергия сохраняется. Можно выразить это как:
| Работа | = | Изменение внутренней энергии |
| + W | = | ΔU |
Где W — работа, произведенная газом, а ΔU — изменение внутренней энергии газа.
Изменение внутренней энергии газа в изотермическом процессе можно выразить через тепло Q, полученное или отданное газом:
| ΔU | = | Q |
Из этих двух уравнений следует, что работа, совершенная газом в изотермическом процессе, равна разности тепла, полученного или отданного газом:
| W | = | Q |
Примеры изотермического процесса в природе и технике
1. Изотермический процесс в газе
Один из самых известных и простых примеров изотермического процесса в природе – это газ, который находится в закрытом сосуде. Если увеличить объем сосуда при постоянной температуре, то давление газа уменьшится пропорционально увеличению объема. Таким образом, газ в сосуде подвергается изотермическому расширению.
2. Изотермический процесс в тепловых двигателях
Внутреннего сгорания тепловые двигатели, такие как двигатели внутреннего сгорания, работают по циклу, который содержит изотермический процесс. Например, в цикле работы четырехтактного двигателя внутреннего сгорания, один из циклов охлаждения и сжатия смеси происходит при постоянной температуре. Это позволяет двигателю эффективно использовать тепловую энергию и преобразовывать ее в механическую работу.
3. Изотермический процесс при адиабатическом расширении
Адиабатическое расширение это расширение газа без обмена тепла с окружающей средой. Однако если адиабатическое расширение происходит при изотермическом условии, то это означает, что газ расширяется без изменения его температуры. Один из примеров адиабатического расширения под изотермическим условием – это работа компрессора в холодильных установках. Компрессор сжимает хладагент, при этом сохраняя постоянную температуру.
4. Изотермический процесс при сгорании топлива
При сгорании топлива в двигателях внутреннего сгорания, происходит изотермический процесс при постоянной температуре. Топливо сгорает при постоянной температуре, что обеспечивает эффективное использование энергии и преобразование ее в полезную работу.
Примеры изотермического процесса в природе и технике демонстрируют значимость поддержания постоянной температуры для эффективного использования энергии и работы систем и механизмов. Эти процессы позволяют нам лучше понять особенности изотермических процессов и применить эту информацию в различных областях нашей жизни.
Закон Бойля-Мариотта и его роль в изотермическом процессе
В соответствии с законом Бойля-Мариотта, при постоянной температуре объем газа обратно пропорционален его давлению. То есть, если давление газа увеличивается, то его объем уменьшается, и наоборот, при уменьшении давления, объем газа увеличивается. Математический вид закона выражается следующей формулой:
P1 * V1 = P2 * V2
Где P1 и V1 — начальное давление и объем газа, а P2 и V2 — конечное давление и объем газа.
Изотермический процесс, при котором закон Бойля-Мариотта выполняется, характеризуется постоянной температурой. Это означает, что в ходе такого процесса энергии не передается между системой и окружающей средой в виде тепла или работы. Изменение объема газа происходит исключительно за счет изменения его давления.
Закон Бойля-Мариотта имеет важное практическое применение. Например, он может использоваться при расчете работы, совершенной газом в ходе изотермического процесса. Также, закон Бойля-Мариотта был одним из первых законов, опирающихся на представление о газе как о множестве молекул, взаимодействующих друг с другом.
Определение закона Бойля-Мариотта
Закон Бойля-Мариотта формулирует зависимость между давлением и объемом газа при постоянной температуре. Согласно этому закону, при идеальных условиях, давление, которое оказывает газ на стенки сосуда, обратно пропорционально его объему.
То есть, если объем газа увеличивается, при постоянной температуре, давление газа уменьшается, и наоборот — если объем газа уменьшается, давление газа увеличивается. Формула, описывающая закон Бойля-Мариотта, выглядит так:
P1 * V1 = P2 * V2
Где P1 и P2 — начальное и конечное давление соответственно, а V1 и V2 — начальный и конечный объемы газа соответственно.
Закон Бойля-Мариотта имеет большое практическое применение в различных областях науки и техники. Одно из простейших применений закона — находится в гидроакустике, где он помогает объяснить процессы распространения звука под водой. Также закон Бойля-Мариотта широко используется в различных отраслях машиностроения, химии и физики газов.
Применение закона Бойля-Мариотта в изотермическом процессе
Изотермический процесс предполагает, что температура системы остается постоянной. Это означает, что при изменении объема газа, его давление будет меняться таким образом, чтобы сохранить постоянную температуру.
Согласно закону Бойля-Мариотта, произведение давления и объема газа при изотермическом процессе остается постоянным. Математически этот закон можно записать следующим образом:
P1V1 = P2V2
Где P1 и P2 — давления газа в начальном и конечном состоянии соответственно, а V1 и V2 — объемы газа в начальном и конечном состоянии соответственно.
Применение закона Бойля-Мариотта в изотермическом процессе позволяет определить, как изменится давление газа при изменении его объема. Например, если изначально давление газа увеличивается вдвое, то его объем должен уменьшиться вдвое, чтобы сохранить постоянную температуру.
Закон Бойля-Мариотта находит широкое применение в различных областях, включая физику, химию и инженерию. Он является важным инструментом для решения задач, связанных с газами и их поведением при изменении давления и объема.
Таким образом, закон Бойля-Мариотта играет существенную роль в изотермическом процессе, позволяя определить зависимость между давлением и объемом газа и является неотъемлемой частью теоретического и практического изучения газовых систем.
Зависимость объема и давления от температуры в изотермическом процессе
В изотермическом процессе, где температура системы остается постоянной, существует прямая зависимость между объемом и давлением газа. Эта зависимость описывается законом Бойля-Мариотта, который гласит, что при постоянной температуре произведение давления и объема газа остается постоянным:
P * V = const
То есть, если увеличить давление на определенное количество, объем газа уменьшится пропорционально, чтобы сохранить константу. Также, если уменьшить давление, объем газа увеличится.
- При увеличении давления на определенный процент, объем газа уменьшится на тот же процент.
- При уменьшении давления на определенный процент, объем газа увеличится на тот же процент.
- При удвоении давления, объем газа уменьшится в два раза.
- При уменьшении давления вдвое, объем газа увеличится в два раза.
Эта прямая зависимость между объемом и давлением в изотермическом процессе может быть объяснена молекулярно-кинетической теорией. При увеличении давления молекулы газа сближаются друг с другом, занимая меньший объем. При уменьшении давления, молекулы газа раздвигаются, занимая больший объем.
Изотермический процесс является одним из важных процессов в термодинамике и широко используется в промышленности и научных исследованиях для контроля и регулирования объема и давления газовых сред.
Особенности изотермического процесса
Основной закон изотермического процесса заключается в том, что давление и объем газа при изотермическом расширении или сжатии связаны пропорциональной зависимостью. Это закон Бойля-Мариотта:
| Давление (P) | Объем (V) |
|---|---|
| Увеличивается | Уменьшается |
| Уменьшается | Увеличивается |
Важной особенностью изотермического процесса является изменение внутренней энергии газа. В отличие от адиабатического процесса, в изотермическом процессе внутренняя энергия газа не изменяется. Это связано с тем, что при изотермическом расширении или сжатии газа, тепло, передаваемое от газа окружающей среде, компенсирует изменение внутренней энергии.
Кроме того, при изотермическом процессе газ испытывает изменение энтропии. Энтропия системы остается постоянной, так как температура системы не меняется. Однако, энтропия окружающей среды может изменяться, сопровождая теплообмен с газом.
Изотермический процесс широко применяется в технике и промышленности, например, в холодильных установках, где необходимо поддерживать постоянную температуру при переносе тепла.
Вопрос-ответ:
Какой закон описывает изотермический процесс?
Изотермический процесс описывается законом Бойля-Мариотта.
Что такое изотермический процесс?
Изотермический процесс — это процесс, в котором температура системы остается постоянной.
Какие особенности имеет изотермический процесс?
Основной особенностью изотермического процесса является сохранение постоянной температуры системы. Кроме того, в изотермическом процессе между давлением и объемом газовой системы существует обратная пропорциональность, а работа, совершаемая газом при расширении или сжатии, равна произведению давления на изменение объема.
Какие примеры изотермических процессов можно найти в природе или технике?
Примерами изотермических процессов являются расширение или сжатие газа в цилиндре с помощью поршня, расширение газа при бесступенчатом переключении скоростей в автомобиле или мотоцикле, процесс конденсации пара в атмосфере и т.д.
Какие уравнения используются для описания изотермического процесса?
Для описания изотермического процесса используются уравнение состояния идеального газа, уравнение Бойля-Мариотта и уравнение Пуассона.
Что такое изотермический процесс?
Изотермический процесс — это термодинамический процесс, при котором температура системы остается постоянной. В таком процессе изменяются другие параметры системы, такие как давление и объем.
Какой закон описывает изотермический процесс?
Изотермический процесс описывается законом Бойля-Мариотта. Согласно этому закону, при постоянной температуре и константе, произведение давления и объема газа остается постоянным.